Nommage des ions est un processus assez simple quand vous comprenez les règles. La première chose à considérer est de savoir si l'ion est positivement ou négativement chargé et si c'est un ion monoatomique ou un ion polyatomique. Vous devez également examiner si l'ion a plus d'un état d'oxydation (contre supplément). Une fois que vous avez répondu à toutes ces questions, vous pouvez suivre quelques étapes simples correctement le nom de l'ion.
Mesures
@@_
@@
Méthode 1
Désignation d'un Ion Monoatomique Avec un Seul État d'Oxydation

1
@@_
@@Mémoriser le tableau périodique. Afin de se rappeler les noms des ions, vous aurez besoin de se rappeler les noms des éléments qui les composent. Commettre le tableau périodique, à la mémoire, et vous aurez un temps beaucoup plus facile de nommage des ions.
- C'est bien de consulter le tableau périodique, si vous ne vous souvenez pas du nom d'un élément.


2
@@_
@@n'oubliez pas d'ajouter le mot ion. Afin de distinguer un ion d'un atome, vous devez utiliser le mot ion à la fin du nom.[1]


3
@@_
@@Utiliser des noms d'élément pour les ions positifs. Le plus simple des ions de nom sont chargés positivement monoatomique d'ions avec un seul des états d'oxydation. Ces tout simplement prendre le même nom que l'élément en forme,.[2]
- Par exemple, le nom de l'élément Na de sodium, de sorte que le nom de Na est l'ion sodium.
- les ions chargés Positivement sont également appelés cations.


4
@@_
@@- ide suffixe pour les ions négatifs. Monoatomique ions ayant une charge négative et un seul état d'oxydation sont nommés à l'aide de la forme de la tige de l'élément nom, avec l'ajout du suffixe -ide.[3]
- Par exemple, le nom de l'élément O2 est de l'oxygène, de sorte que le nom de O2 - est de l'oxyde d'ions. Le nom de l'élément F est le fluor, de sorte que le nom de F - est l'ion fluorure.
- ion chargé Négativement sont également connus comme les anions.
@@_
@@
Méthode 2
Désignation d'un Ion Monoatomique Avec Plusieurs États d'Oxydation

1
@@_
@@Sais laquelle les ions peuvent avoir plus d'un état d'oxydation. L'état d'oxydation de l'ion signifie simplement combien d'électrons qu'il gagne ou perd. La plupart des métaux de transition, qui sont regroupées dans le tableau périodique des éléments, ont plus d'un état d'oxydation.[4]
- L'état d'oxydation d'un ion est égale à sa charge, ce qui est le nombre d'électrons de l'ion.
- le Scandium et le zinc sont les deux seules les métaux de transition qui n'ont pas plus d'un état d'oxydation.
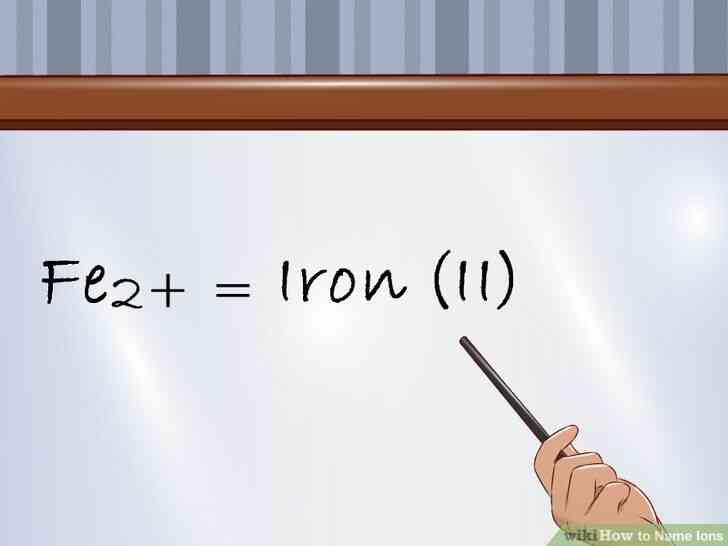
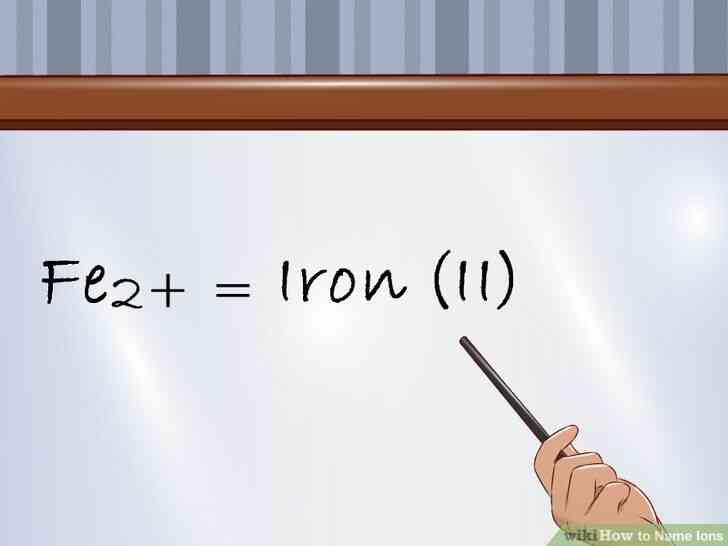
2
@@_
@@Utiliser le système romain. La façon la plus courante pour indiquer l'état d'oxydation d'un ion est d'utiliser les chiffres romains entre parenthèses pour indiquer la charge.[5]
- Continuer à utiliser le nom de l'élément que vous le feriez pour un ion positif. Par exemple, le Fe2 est appelé fer (II) ion.
- les métaux de Transition ne portent pas de charges négatives, de sorte que vous n'aurez pas à vous inquiéter au sujet de l'ajout de l'-ide suffixe.[6]


3
@@_
@@ - Être familier avec l'ancien système. Alors que le système romain est plus commun aujourd'hui, vous rencontrerez peut-être le plus vieux système de nommage, notamment sur les étiquettes. Ce système ajoute le suffixe -unités de l'ion le plus faible de charge positive, et le suffixe -ic pour l'ion le plus élevé de la charge positive.[7]
- Les suffixes -unités et l'-ci est relative, ce qui signifie qu'ils ne correspondent pas directement à des numéros. Par exemple, le fer (II) ion serait appelé ion ferreux à l'aide de l'ancien système, et de fer (III) d'ions seraient appelés ions ferriques, parce que le fer (II) a un faible niveau de charge positive que le fer (III). De même, le cuivre (I) ion serait appelé cuivreux ion et ion cuivre (II) serait appelé ion cuivrique en raison de cuivre (I) a un faible niveau de charge positive que le cuivre (II).
- Ce système ne fonctionne pas bien pour les ions qui peuvent avoir plus de deux charges, c'est pourquoi le système romain est préféré.
@@_
@@
Méthode 3
Désignation d'un Ion Polyatomique

1
@@_
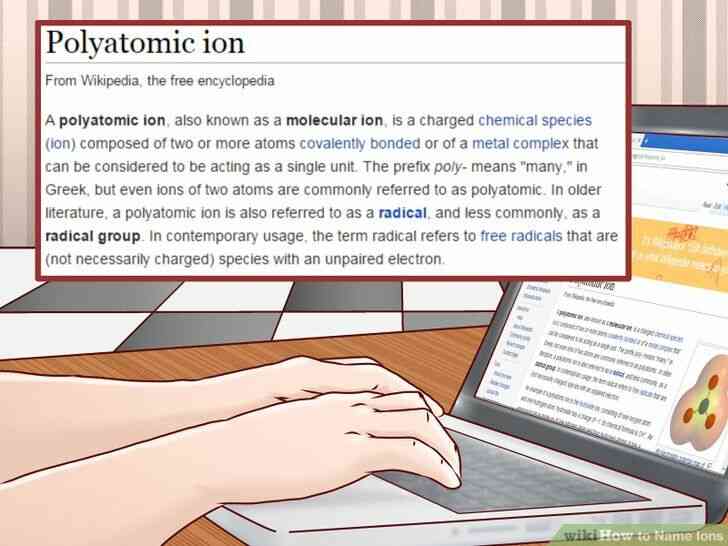
@@Comprendre ce qu'est un ion polyatomique est. Ions polyatomiques sont simplement des ions qui contiennent plus d'un type d'élément. Ils sont distincts composés ioniques, qui sont formés lorsque les ions chargés positivement lien avec les ions chargés négativement.[8]


2
@@_
@@Mémoriser les noms de communes des ions polyatomiques. Le système de nommage pour les ions polyatomiques est assez complexe, de sorte que vous voudrez peut-être commencer par la mémorisation de ceux que vous aurez besoin de rappeler le plus souvent.[9]
- Commune ions polyatomiques inclure des ions bicarbonates (HCO3-), de l'hydrogène ion sulfate ou bisulfate ion (HSO4-), acétate d'ions (CH3CO2-), les ions perchlorate (ClO4-), l'ion nitrate (NO3-), les ions chlorate (ClO3-), l'ion nitrite (NO2-), les ions chlorite (ClO2-), les ions permanganate (MnO4-), l'ion hypochlorite (ClO-), les ions cyanure (CN-), les ions hydroxyde (OH-), les ions carbonates (CO32-), le peroxyde d'ions (O22-), l'ion sulfate (SO42-), ion chromate (CrO42-), ion sulfite (SO32-), les ions dichromate (Cr2O72-), les ions thiosulfate (S2O32-), de l'hydrogène ion phosphate (HPO42-), ion phosphate (PO43-), l'arséniate d'ions (AsO43-), et de l'ion borate (BO33-)
- L'ion ammonium (NH4 ), est le seul chargé positivement ion polyatomique (ou polyatomiques cation).[10]


3
@@_
@@Apprendre le profil de chargé négativement polyatomiques atomes. Bien que complexe, il existe un modèle pour le système de nommage pour les chargés négativement ions polyatomiques (ou polyatomiques anions). Une fois que vous comprendre le modèle, vous serez en mesure d'en nommer un ion.[11]
- Utilisez l'-ite suffixe pour indiquer un faible état d'oxydation. Par exemple, le NO2 - ion est l'ion nitrite.
- Utilisez l'-ate suffixe pour indiquer un fort état d'oxydation. Par exemple, le NO3 - ion est l'ion nitrate.
- Utiliser l'hypo - préfixe pour indiquer le plus bas état d'oxydation. Par exemple, le ClO - ion est l'ion hypochlorite.
- Utiliser le préfixe (comme dans l'hyper-) pour indiquer le plus haut état d'oxydation. Par exemple, le ClO4 - ion est l'ion perchlorate.
- des Exceptions à la tendance inclure hydroxyde (OH-), cyanure (CN-), et de peroxyde (O22-) d'ions, qui ont l'ide de fin parce qu'ils ont été une fois pensé pour être monatomic ions.
Comment nommer les Ions
Nommage des ions est un processus assez simple quand vous comprenez les regles. La premiere chose a considerer est de savoir si l'ion est positivement ou negativement charge et si c'est un ion monoatomique ou un ion polyatomique. Vous devez egalement examiner si l'ion a plus d'un etat d'oxydation (contre supplement). Une fois que vous avez repondu a toutes ces questions, vous pouvez suivre quelques etapes simples correctement le nom de l'ion.
Mesures
@@_
@@
Methode 1
Designation d'un Ion Monoatomique Avec un Seul Etat d'Oxydation


1
@@_
@@Memoriser le tableau periodique. Afin de se rappeler les noms des ions, vous aurez besoin de se rappeler les noms des elements qui les composent. Commettre le tableau periodique, a la memoire, et vous aurez un temps beaucoup plus facile de nommage des ions.
- C'est bien de consulter le tableau periodique, si vous ne vous souvenez pas du nom d'un element.


2
@@_
@@n'oubliez pas d'ajouter le mot ion. Afin de distinguer un ion d'un atome, vous devez utiliser le mot ion a la fin du nom.[1]


3
@@_
@@Utiliser des noms d'element pour les ions positifs. Le plus simple des ions de nom sont charges positivement monoatomique d'ions avec un seul des etats d'oxydation. Ces tout simplement prendre le meme nom que l'element en forme,.[2]
- Par exemple, le nom de l'element Na de sodium, de sorte que le nom de Na est l'ion sodium.
- les ions charges Positivement sont egalement appeles cations.


4
@@_
@@- ide suffixe pour les ions negatifs. Monoatomique ions ayant une charge negative et un seul etat d'oxydation sont nommes a l'aide de la forme de la tige de l'element nom, avec l'ajout du suffixe -ide.[3]
- Par exemple, le nom de l'element O2 est de l'oxygene, de sorte que le nom de O2 - est de l'oxyde d'ions. Le nom de l'element F est le fluor, de sorte que le nom de F - est l'ion fluorure.
- ion charge Negativement sont egalement connus comme les anions.
@@_
@@
Methode 2
Designation d'un Ion Monoatomique Avec Plusieurs Etats d'Oxydation


1
@@_
@@Sais laquelle les ions peuvent avoir plus d'un etat d'oxydation. L'etat d'oxydation de l'ion signifie simplement combien d'electrons qu'il gagne ou perd. La plupart des metaux de transition, qui sont regroupees dans le tableau periodique des elements, ont plus d'un etat d'oxydation.[4]
- L'etat d'oxydation d'un ion est egale a sa charge, ce qui est le nombre d'electrons de l'ion.
- le Scandium et le zinc sont les deux seules les metaux de transition qui n'ont pas plus d'un etat d'oxydation.
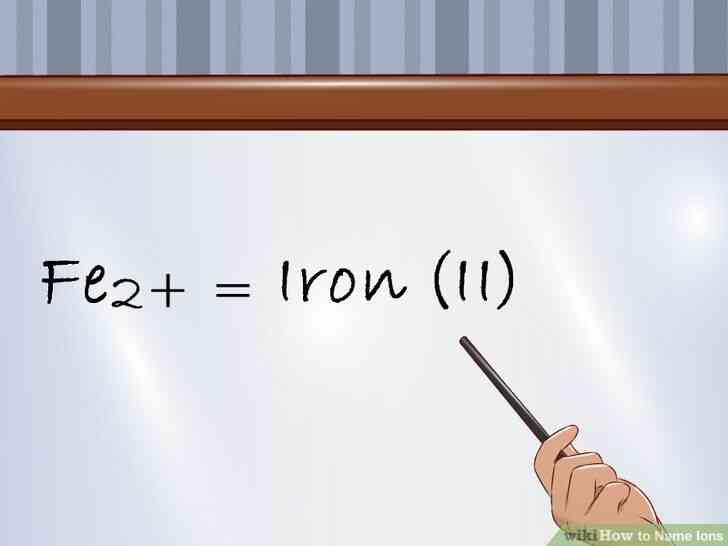
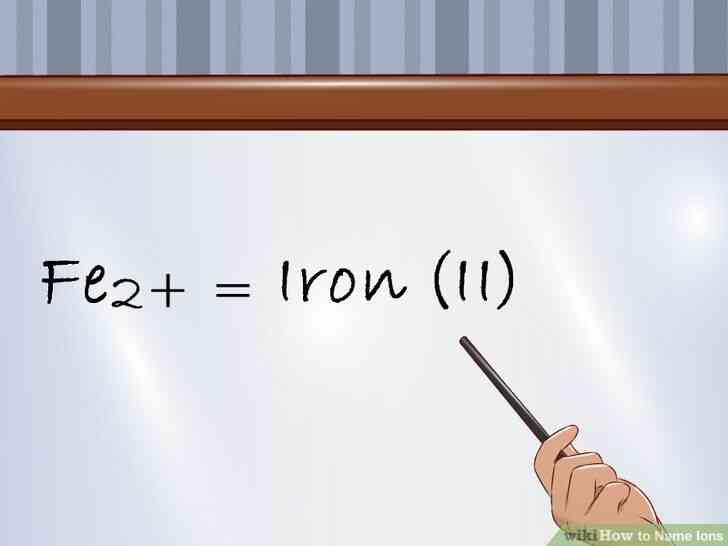
2
@@_
@@Utiliser le systeme romain. La façon la plus courante pour indiquer l'etat d'oxydation d'un ion est d'utiliser les chiffres romains entre parentheses pour indiquer la charge.[5]
- Continuer a utiliser le nom de l'element que vous le feriez pour un ion positif. Par exemple, le Fe2 est appele fer (II) ion.
- les metaux de Transition ne portent pas de charges negatives, de sorte que vous n'aurez pas a vous inquieter au sujet de l'ajout de l'-ide suffixe.[6]


3
@@_
@@ - Etre familier avec l'ancien systeme. Alors que le systeme romain est plus commun aujourd'hui, vous rencontrerez peut-etre le plus vieux systeme de nommage, notamment sur les etiquettes. Ce systeme ajoute le suffixe -unites de l'ion le plus faible de charge positive, et le suffixe -ic pour l'ion le plus eleve de la charge positive.[7]
- Les suffixes -unites et l'-ci est relative, ce qui signifie qu'ils ne correspondent pas directement a des numeros. Par exemple, le fer (II) ion serait appele ion ferreux a l'aide de l'ancien systeme, et de fer (III) d'ions seraient appeles ions ferriques, parce que le fer (II) a un faible niveau de charge positive que le fer (III). De meme, le cuivre (I) ion serait appele cuivreux ion et ion cuivre (II) serait appele ion cuivrique en raison de cuivre (I) a un faible niveau de charge positive que le cuivre (II).
- Ce systeme ne fonctionne pas bien pour les ions qui peuvent avoir plus de deux charges, c'est pourquoi le systeme romain est prefere.
@@_
@@
Methode 3
Designation d'un Ion Polyatomique


1
@@_
@@Comprendre ce qu'est un ion polyatomique est. Ions polyatomiques sont simplement des ions qui contiennent plus d'un type d'element. Ils sont distincts composes ioniques, qui sont formes lorsque les ions charges positivement lien avec les ions charges negativement.[8]


2
@@_
@@Memoriser les noms de communes des ions polyatomiques. Le systeme de nommage pour les ions polyatomiques est assez complexe, de sorte que vous voudrez peut-etre commencer par la memorisation de ceux que vous aurez besoin de rappeler le plus souvent.[9]
- Commune ions polyatomiques inclure des ions bicarbonates (HCO3-), de l'hydrogene ion sulfate ou bisulfate ion (HSO4-), acetate d'ions (CH3CO2-), les ions perchlorate (ClO4-), l'ion nitrate (NO3-), les ions chlorate (ClO3-), l'ion nitrite (NO2-), les ions chlorite (ClO2-), les ions permanganate (MnO4-), l'ion hypochlorite (ClO-), les ions cyanure (CN-), les ions hydroxyde (OH-), les ions carbonates (CO32-), le peroxyde d'ions (O22-), l'ion sulfate (SO42-), ion chromate (CrO42-), ion sulfite (SO32-), les ions dichromate (Cr2O72-), les ions thiosulfate (S2O32-), de l'hydrogene ion phosphate (HPO42-), ion phosphate (PO43-), l'arseniate d'ions (AsO43-), et de l'ion borate (BO33-)
- L'ion ammonium (NH4 ), est le seul charge positivement ion polyatomique (ou polyatomiques cation).[10]


3
@@_
@@Apprendre le profil de charge negativement polyatomiques atomes. Bien que complexe, il existe un modele pour le systeme de nommage pour les charges negativement ions polyatomiques (ou polyatomiques anions). Une fois que vous comprendre le modele, vous serez en mesure d'en nommer un ion.[11]
- Utilisez l'-ite suffixe pour indiquer un faible etat d'oxydation. Par exemple, le NO2 - ion est l'ion nitrite.
- Utilisez l'-ate suffixe pour indiquer un fort etat d'oxydation. Par exemple, le NO3 - ion est l'ion nitrate.
- Utiliser l'hypo - prefixe pour indiquer le plus bas etat d'oxydation. Par exemple, le ClO - ion est l'ion hypochlorite.
- Utiliser le prefixe (comme dans l'hyper-) pour indiquer le plus haut etat d'oxydation. Par exemple, le ClO4 - ion est l'ion perchlorate.
- des Exceptions a la tendance inclure hydroxyde (OH-), cyanure (CN-), et de peroxyde (O22-) d'ions, qui ont l'ide de fin parce qu'ils ont ete une fois pense pour etre monatomic ions.
Comment nommer les Ions
By commentfaire
Nommage des ions est un processus assez simple quand vous comprenez les règles. La première chose à considérer est de savoir si l'ion est positivement ou négativement chargé et si c'est un ion monoatomique ou un ion polyatomique. Vous devez également examiner si l'ion a plus d'un état d'oxydation (contre supplément). Une fois que vous avez répondu à toutes ces questions, vous pouvez suivre quelques étapes simples correctement le nom de l'ion.